Алканы :
Алканы - это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула -
Физические свойства :
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях неразветвлённые алканы с CH 4 до C 4 H 10 - газы; с C 5 H 12 до C 13 H 28 - жидкости; после C 14 H 30 - твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан - жидкость, а неопентан - газ.
Химические свойства:
· Галогенирование
это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно - за один этап замещается не более одного атома водорода:
- CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
- CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН 3 , которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
· Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
С n Н 2n +2 +(1,5n +0,5)O 2 = n CO 2 + (n +1)H 2 O
· Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH 4 → C + 2H 2 (t > 1000 °C)
C 2 H 6 → 2C + 3H 2
Алкены :
Алкены-это непредельные углеводороды,содержащие в молекуле,кроме одинарных связей,одну двойную углерод-углеродную связь.Формула- C n H 2n
Принадлежность углеводорода к классу алкенов отражают родовым суффиксом –ен в его названии.
Физические свойства :
- Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C 2 H 4 до C 4 H 8 - газы; с C 5 H 10 до C 17 H 34 - жидкости, после C 18 H 36 - твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства :
· Дегидратация -это процесс отщепления молекулы воды от молекулы органического соединения.
· Полимеризация -это химический процесс соединения множества исходных молекул низкомолекулярного вещества в крупные молекулы полимера.
Полимер -это высокомолекулярное соединение,молекулы которого состоят из множества одинаковых структурных звеньев.
Алкадиены :
Алкадиены -это непредельные углеводороды, содержащие в молекуле,кроме одинрных связей,дведвойные углерод-углеродные связи.Формула-
. Диены являются структурными изомерамиалкинов.Физические свойства :
Бутадие́н - газ (tкип −4,5 °C), изопрен - жидкость, кипящая при 34 °C, диметилбутадиен - жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Каучук хорошо растворим в бензоле, бензине, сероуглероде. При низкой температуре становится ломким, при нагревании липким. Для улучшения механических и химических свойств каучука его превращают в резину, подвергая вулканизации. Для получения резиновых изделий сначала их формуют из смеси каучука с серой, а также с наполнителями: сажей, мелом, глиной и некоторыми органическими соединениями, служащими для ускорения вулканизации. Затем изделия нагревают - горячая вулканизация. При вулканизации сера химически связывается с каучуком. Кроме того, в вулканизированном каучуке сера содержится в свободном состоянии в виде мельчайших частиц.
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука. Вступают в реакции присоединения (гидрирование, галогенирование, гидрогалогенирование):
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
Алкины :
Алкины-этонепредельные углеводороды молекулы которых содержат,помимо одинарных связей,одну тройную углерод-глеродную связь.Формула-C n H 2n-2
Физические свойства :
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С 4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
Алкины плохо растворимы в воде, лучше - в органических растворителях.
Химические свойства :
· Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
· Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов)

Химические свойства алканов
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом S R .
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
RH + XY → RX + HY
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
|
Механизм реакции Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl , Н, СН 3 , СН 2 и т.д.); 2. Развитие цепи Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора: 3) Обрыв (гибель) цепи: Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы: |
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО 4 , К 2 Cr 2 О 7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
CH 4 + 2O 2 = CO 2 + 2H 2 O
Б) неполное сгорание при недостатке кислорода:
2CH 4 + 3O 2 = 2CO + 4H 2 O
CH 4 + O 2 = C + 2H 2 O
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 о С) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH 2 -CH 2 -CH 3 + CH 3 -CH=CH 2
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С-Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
2CH 4 → C 2 H 2 + 3H 2
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
СН 4 → С + 2Н 2
При дегидрировании остальных алканов образуются алкены:
C 2 H 6 → C 2 H 4 + H 2
При дегидрировании н -бутана образуется бутен или бутен-2 (смесь цис- и транс -изомеров):
Дегидроциклизация
Изомеризация
Химические свойства циклоалканов
Химические свойства циклоалканов с числом атомов углерода в циклах больше четырех, в целом практически идентичны свойствам алканов. Для циклопропана и циклобутана, как ни странно, характерны реакции присоединения. Это обусловлено большим напряжением внутри цикла, которое приводит к тому, что данные циклы стремятся разорваться. Так циклопропан и циклобутан легко присоединяют бром, водород или хлороводород:
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH 3 -СН=СН 2 + Н 2 → CH 3 -СН 2 -СН 3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН 2 =СН 2 + Br 2 → CH 2 Br-CH 2 Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH 2 =CH 2 + H 2 O → CH 3 -CH 2 -OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
C n H 2n+2 + O 2 → nCO 2 + (n+1)H 2 O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO 4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Химические свойства алкадиенов
Реакции присоединения
Например, присоединение галогенов:
Бромная вода обесцвечивается.
В обычных условиях присоединение атомов галогена происходит по концам молекулы бутадиена-1,3, при этом π-связи разрываются, к крайним атомам углерода присоединяются атомы брома, а свободные валентности образуют новую π-связь. Таким образом, как бы происходит «перемещение» двойной связи. При избытке брома может быть присоединена еще одна его молекула по месту образовавшейся двойной связи.
Реакции полимеризации
Химические свойства алкинов
Алкины являются ненасыщенными (непредельными) углеводородами в связи с чем способны вступать в реакции присоединения. Среди реакци присоединения для алкинов наиболее распространено электрофильное присоединение.
Галогенирование
Поскольку тройная связь молекул алкинов состоит из одной более прочной сигма-связи и двух менее прочных пи-связей они способны присоединять как одну, так и две молекулы галогена. Присоединение одной молекулой алкина двух молекул галогена протекает по электрофильному механизму последовательно в две стадии:
Гидрогалогенирование
Присоединение молекул галогеноводорода, также протекает по электрофильному механизму и в две стадии. В обоих стадиях присоединение идет в соответствии с правилом Марковникова:
Гидратация
Присоединение воды к алкинами происходит в присутсвии солей рути в кислой среде и называется реакцией Кучерова.
В результате гидратации присоединения воды к ацетилену ообразуется ацетальдегид (укусный альдегид):
Для гомологов ацетилена присоединение воды приводит к образованию кетонов:
Гидрирование алкинов
Алкины реагируют с водородом в две ступени. В качестве катализаторов используют такие металлы как платина, палладий, никель:
Тримеризация алкинов
При пропускании ацетилена над активированным углем при высокой температуре из него образуется смесь различных продуктов, основным из которых является бензол – продукт тримеризации ацетилена:
Димеризация алкинов
Также ацетилен вступать в реакцию димеризации. Процесс протекает в присутствии солей меди как катализаторов:
Окисление алкинов
Алкины сгорают в кислороде:
С n H 2n-2 + (3n-1)/2 O 2 → nCO 2 + (n-1)H 2 O
Взаимодействие алкинов с основаниями
Алкины с тройной C≡C на конце молекулы, в отличие от остальных алкинов, способны вступать в реакции, в которых атом водорода при тройной связи замещается металл. Например, ацетилен реагирует с амидом натрия в жидком аммиаке:
HC≡CH + NaNH 2 → NaC≡CNa + 2NH 3 ,
а также с аммиачным раствором оксида серебра, образуя нерастворимые солеподобные вещества называемые ацетиленидами:
Благодаря такой реакции можно распознать алкины с концевой тройной связью, а также выделить такой алкин из смеси с другими алкинами.
Следует отметить, что все ацетилениды серебра и меди являются взрывоопасными веществами.
Ацетилениды способны реагировать с галогенпроизводными, что используется при синтезе более сложных органических соединений с тройной связью:
СН 3 -C≡CН + 2NaNН 2 → СН 3 -C≡CNa + NН 3
СН 3 -C≡CNa + CH 3 Br → СН 3 -C≡C-СН 3 + NaBr
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.<
Реакции присоединения
Гидрирование
Присоединение хлора
Протекает по радикальному механизму при интенсивном облучении ультрафиолетовым светом:
Подобным образом реакция может протекать только с хлором.
Реакции окисления
Горение
2С 6 Н 6 + 15О 2 = 12СО 2 + 6Н 2 О+Q
Неполное окисление
Бензольное кольцо устойчиво к действию таких окислителей как KMnO 4 и K 2 Cr 2 O 7 . Реакция не идет.
Деление заместителей в бензольном кольце на два типа:
Рассмотрим химические свойства гомологов бензола на примере толуола.
Химические свойства толуола
Галогенирование
Молекулу толуола можно рассматривать, как состоящую из фрагментов молекул бензола и метана. Поэтому логично предположить, что химические свойства толуола должны в какой-то мере сочетать химические свойства этих двух веществ, взятых по отдельности. В частyости, именно это и наблюдается при его галогенировании. Мы уже знаем, что бензол вступает в реакцию замещения с хлором по электрофильному механизму, и для осуществления данной реакции необходимо использовать катализаторы (галогениды алюминия или трехвалентного железа). В то же время метан так же способен реагировать с хлором, но уже по свободно-радикальному механизму, для чего требуется облучение исходной реакционной смеси УФ-светом. Толуол, в зависимости от того, в каких условиях подвергается хлорированию, способен дать либо продукты замещения атомов водорода в бензольном кольце – для это нужно использовать те же условия что и при хлорировании бензола, либо продукты замещения атомов водорода в метильном радикале, если на него, как и на метан действовать хлором при облучении ультрафиолетом:
Как можно заметить хлорирование толуола в присутствии хлорида алюминия привело к двум разным продуктам – орто- и пара-хлортолуолу. Это обусловлено тем, что метильный радикал является заместителем I рода.
Если хлорирование толуола в присутсвии AlCl 3 проводить в избытке хлора, возможно образование трихлорзамещенного толуола:
Аналогично при хлорировании толуола на свету при большем соотношении хлор/толуол можно получить дихлорметилбензол или трихлорметилбензол:
Нитрование
Замещение атомов водорода на нитрогрппу, при нитровании толуола смесью концентрированных азотной и серной кислот, приводит к продуктам замещения в ароматическом ядре, а не метильном радикале:
Алкилирование
Как уже было сказано метильный радикал, является ориентантом I рода, поэтому его алкилирование по Фриделю-Крафтсу приводит продуктам замещения в орто- и пара-положения:
Реакции присоединения
Толуол можно прогидрировать до метилциклогексана при использовании металлических катализаторов (Pt, Pd, Ni):
С 6 Н 5 СН 3 + 9O 2 → 7СO 2 + 4Н 2 O
Неполное окисление
При действии такого окислителя, как водный раствор перманганата калия окислению подвергается боковая цепь. Ароматическое ядро в таких условиях окислиться не может. При этом в зависимости от pH раствора будет образовываться либо карбоновая кислота, либо ее соль.
Определение 1
Алканами называют такие углеводороды, атомы углерода, в молекулах которых соединены между собой простыми (одинарными) $\sigma $- связями. Все остальные единицы валентности атомов углерода в этих соединениях заняты (насыщенны) атомами водорода.
Атомы углерода в молекулах насыщенных углеводородов находятся в первом валентном состоянии, то есть в состоянии $sp3$-гибридизации. Такие насыщенные углеводороды еще называют парафинами .
Парафинами эти органические соединения называют потому, что долгое время их считали малореакцийноспособными (от лат. parum - мало и affinis - имеет сродство).
Старое название насыщенных углеводородов - алифатические или жирные, углеводороды (от лат. alifatic - жирный). Это название происходит от названия первых изученных соединений, которые когда-то относили к этим веществам, - жиров.
Насыщенные углеводороды образуют ряд соединений с общей формулой $C_nH_{(2_n+2)}$ $(n - 1, 2, 3, 4, ...)$. Простой соединением этого ряда является метан $CH_4$. Поэтому ряд этих соединений называют еще рядом метановых углеводородов.
Гомологические ряды
Соединения ряда метана имеют подобные строение и свойства. Такой ряд соединений, представители которого имеют близкие химические свойства и характеризуются закономерной сменой физических свойств, имеют однотипную структуру и отличаются друг от друга на одну или несколько $-CH_2$-групп, называют гомологичным рядом (от греч. «гомос » - сходство). Каждый последующий углеводород данного ряда отличается от предыдущего на группу $-CH_2$. Эта группа называется гомологичной разницей, а отдельные члены этого ряда - гомологами.
Происхождение названий алканов
Названия первых четырех насыщенных углеводородов (метан, этан, пропан, бутан) возникли случайно. Например, корень слова «этан» произошел от латинского слова ether - эфиы, так как остаток этана $-C_2H_5$ входит в состав медицинского эфира. Начиная с $C_5H_{12}$, названия алканов образованы от греческих или латинских числительных, которые указывают количество углеродных атомов в молекуле данного насыщенного углеводорода с добавлением к этим названиям суффикса -ан. Так, углеводород $C_5H_{12}$ называется пентан (от греч. «пента » - пять), $C_6H_{14}$ - гексан (от греч. «гекса » - шесть), $C_7H_{10}$ - гептан (от греч. «гепта » - семь) и т. д.
Правила систематической номенклатуры
Для названия органических веществ комиссией Международного союза теоретической и прикладной химии (IUPAC) были разработаны правила систематической (научной) номенклатуры. Согласно этим правилам, названия углеводородам дают таким образом:
В молекуле углеводорода выбирают основную - длинную и сложную (которая имеет наибольшее число ответвлений) - углеродную цепь.
Нумеруют атомы углерода основной цепи. Нумерацию осуществляют последовательно с того конца цепи, который дает радикалу наименьший номер. Если существует несколько алкильных радикалов, то сравнивают величину цифр двух возможных последовательных нумерации. И нумерация, в которой первой встречается меньше цифра, чем во второй последовательной нумерации, считается «меньше» и используется для составления названия углеводорода.
Нумерация справа налево будет «меньше», чем нумерация слева направо.
Называют углеводородные радикалы, которые образуют боковые цепи. Перед названием каждого радикала ставят цифру, которая указывает номер углеродного атома главной цепи, у которого с находится данный радикал. Цифру от названия отделяют дефисом. Названия алкильных радикалов перечисляют в алфавитном порядке. Если углеводород имеет в своем составе несколько одинаковых радикалов, то записывают в порядке возрастания номера углеродных атомов, у которых стоят эти радикалы. Цифры отделяют друг от друга запятыми. После цифр записывают префиксы: ди- (если одинаковых радикалов два), три- (когда одинаковых радикалов три), тетра-, пента- и т. д. (если одинаковых радикалов соответственно четыре, пять и т. д.). Префиксы указывают, сколько одинаковых радикалов имеет данный углеводород. После префикса ставят название радикала. В том случае, если два одинаковых радикалы находятся у одного углеродного атома, номер этого атома углерода ставится в названии дважды.
Называют углеводород основной пронумерованной углеродной цепи, помня при этом, что названия всех насыщенных углеводородов имеют суффикс -ан.
Приведенный ниже пример поможет уяснить эти правила:
Рисунок 1.
Алкильные радикалы боковых цепей
Иногда алкильные радикалы боковых цепей разветвленные. В этом случае их называют так, как соответствующие насыщенные углеводороды, только вместо суффикса -ан принимают суффикс -ил.
Углеродную цепь разветвленного радикала нумеруют. Атом углерода этого радикала, соединенный с основным цепью, получает номер $1$. Для удобства углеродную цепь разветвленного радикала нумеруют цифрами со штрихами и полное название такого радикала берут в скобки:
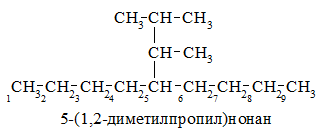
Рисунок 2.
Рациональная номенклатура
Кроме систематической для названия насыщенных углеводородов используют еще рациональную номенклатуру. По этой номенклатуре насыщенные углеводороды рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на радикалы. Название насыщенного углеводорода по рациональной номенклатуре образуют таким образом: называют по степени сложности все радикалы, которые находятся у атома углерода с наибольшим количеством заместителей (отмечая их количество, если они одинаковые), а затем добавляют основу названия углеводорода по этой номенклатуре - слово «метан». К примеру:
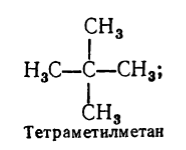
Рисунок 3.
Рациональную номенклатуру пользуются для названия сравнительно простых углеводородов. Эта номенклатура не так усовершенствована и гораздо менее удобна в пользовании по сравнению с систематической номенклатурой. По рациональной номенклатуре одно и то же вещество может иметь разные названия, что очень неудобно. Кроме того, по данной номенклатуре можно назвать далеко не все насыщенные углеводороды.
Химические свойства. Физические свойства алканов
Физические свойства алканов
В обычных условиях первые четыре члена гомологического ряда алканов (С 1 - С 4) - газы. Нормальные алканы от пентана до гептадекана (С 5 - С 17) - жидкости, начиная с С 18 и выше - твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов.
При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, т.к. их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких, как бензол, тетрахлорметан и т.п.
Строение
Молекула простейшего алкана - метана - имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах - атомы водорода. Углы между осями связей С-Н составляют 109°28" (рис. 29).
В молекулах других предельных углеводородов углы между связями (как С-Н, так и С-С) имеют такое же значение. Для описания формы молекул используется понятие гибридизации атомных орбиталей (см. часть I, §6).
В алканах все атомы углерода находятся в состоянии sp 3 - гибридизации (рис. 30).
Таким образом, атомы углерода в углеродной цепи не находятся на одной прямой. Расстояние между соседними атомами углерода (между ядрами атомов) строго фиксировано - это длина химической связи (0,154 нм). Расстояние С 1 - С 3 , С 2 - С 4 и т.д. (через один атом) тоже постоянны, т.к. постоянен угол между связями -валентный угол.

Расстояния между более удаленными атомами углерода могут изменяться (в некоторых пределах) в результате вращения вокруг s-связей. Такое вращение не нарушает перекрывания орбиталей, образующих s-связь, поскольку эта связь имеет осевую симметрию.


Разные пространственные формы одной молекулы, образующиеся при вращении групп атомов вокруг s-связей, называют конформациями (рис. 31).
Конформации различают по энергии, но это различие невелико (12-15 кДж/моль). Более устойчивы такие конформации алканов, в которых атомы расположены возможно дальше друг от друга (отталкивание электронных оболочек). Переход от одной конформации к другой осуществляется за счет энергии теплового движения. Для изображения конформации используют специальные пространственные формулы (формулы Ньюмена).
Не путать!
Следует различать понятия конформация и конфигурация.
Разные конформации могут превращаться друг в друга без разрыва химических связей. Для превращения молекулы с одной конфигурацией в молекулу с другой конфигурацией требуется разрыв химических связей.
Из четырех видов изомерии для алканов характерны два: изомерия углеродного скелета и оптическая изомерия (см. часть
Химические связи в алканах, их разрыв и образование определяют химические свойства алканов. Связи С-С и С-Н ковалентные, простые (s-связи), практически неполярные, достаточно прочные, поэтому:
1) алканы вступают чаще всего в такие реакции, которые идут с гемолитическим разрывом связей;
2) по сравнению с органическими соединениями других классов алканы обладают низкой реакционной способностью (их за это называют парафинами - «лишенными свойства»). Так, алканы устойчивы к действию водных растворов кислот, щелочей и окислителей (например, перманганата калия) даже при кипячении.
Алканы не вступают в реакции присоединения к ним других молекул, т.к. алканы не имеют в своих молекулах кратных связей.
Алканы подвергаются разложению при сильном нагревании в присутствии катализаторов в виде платины или никеля, при этом от алканов отщепляется водород.
Алканы могут вступать в реакции изомеризации. Характерной реакцией для них является реакция замещения, протекающая по радикальному механизму.
Химические свойства
Реакции радикального замещения
В качестве примера рассмотрим взаимодействие алканов с галогенами. Фтор реагирует очень энергично (как правило, со взрывом) - при этом рвутся все С-Н и С-С связи, и в результате образуются соединения CF 4 и HF. Практического значения реакция не имеет. Иод с алканами не взаимодействует. Реакции с хлором или бромом идут либо при освещении, либо при сильном нагревании; при этом происходит образование от моно- до полигалогензамещенных алканов, например:
СН 3 -СН 3 +Сl 2 ® hv СН 3 -СН 2 -Сl+НСl
Образование галогенопроизводных метана протекает по цепному свободнорадикальному механизму. Под действием света молекулы хлора распадаются на неорганические радикалы:
Неорганический радикал Сl . отрывает от молекулы метана атом водорода с одним электроном, образуя НС1 и свободный радикал СН 3
![]()
Свободный радикал взаимодействует с молекулой хлора Сl 2 , образуя галогенопроизводное и радикал хлора.
![]()
Реакция окисления начинается с отрыва атома водорода молекулой кислорода (которая представляет собой бирадикал) и далее идет как разветвленная цепная реакция. Количество радикалов в ходе реакции увеличивается. Процесс сопровождается
выделением большого количества теплоты, рвутся уже не только С-Н, но и С-С связи, так что в результате образуется оксид углерода (IV) и вода. Реакция может протекать как горение или приводит к взрыву.
2С n Н2 n+2 +(3n+1)О 2 ®2nСO 2 +(2n+2)Н 2 O
При обычной температуре реакция окисления не идет; ее можно инициировать либо поджиганием, либо действием электрического разряда.
При сильном нагревании (свыше 1000°С) алканы полностью разлагаются на углерод и водород. Эта реакция называется пиролизом.
СН 4 ® 1200° С+2Н 2
При мягком окислении алканов, в частности метана, кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота.

Если метан пропускать через нагретую зону очень быстро, а затем сразу охлаждать водой, то в результате образуется ацетилен.
Эта реакция - основа промышленного синтеза, который называется крекингом (неполным разложением) метана.
Крекинг гомологов метана проводят при более низкой температуре (около 600°С). Например, крекинг пропана включает следующие стадии:

Итак, крекинг алканов приводит к образованию смеси алканов и алкенов меньшей молекулярной массы.
Нагревание алканов до 300-350°С (крекинг еще не идет) в присутствии катализатора (Pt или Ni) приводит к дегидрированию - отщеплению водорода.

При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:
СН 3 -СН 3 + HNO 3 ®CH 3 -CH 2 -NO 2 + Н 2 О Изомеризация
При определенных условиях алканы нормального строения могут превращаться в алканы с разветвленной цепью.
Получение алканов
Рассмотрим получение алканов на примере получения метана. Метан широко распространен в природе. Он является главной составной частью многих горючих газов, как природных (90-98%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дна болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным газом или рудничным газом.
В лаборатории метан получают при нагревании смеси ацетата натрия с гидроксидом натрия:
CH 3 COONa+NaOH® 200° Na 2 CO 3 +CH 4
или при взаимодействии карбида алюминия с водой: Аl 4 Сl 3 +12H 2 O®4Аl(ОН) 3 +3CH 4
В последнем случае метан получается весьма чистым.
Метан может быть получен из простых веществ при нагревании в присутствии катализатора:
С+2Н 2 ® Ni СН 4 8 также синтезом на основе водяного газа
CO+3H 2 ® Ni CH 4 +H 2 O
Этот способ имеет промышленное значение. Однако используют обычно метан природных газов или газов, образующихся при коксовании каменных углей и при переработке нефти.
Гомологи метана, как и метан, в лабораторных условиях получают прокаливанием солей соответствующих органических кислот с щелочами. Другой способ - реакция Вюрца, т.е. нагревание моногалогенопроизводных с металлическим натрием, например:
С 2 Н 5 Br+2Na+BrC 2 H 6 ® С 2 Н 5 -С 2 Н 5 +2NaBr
В технике для получения технического бензина (смесь углеводородов, содержащих 6-10 атомов углерода) применяют синтез
из оксида углерода (II) и водорода в присутствии катализатора (соединения кобальта) и при повышенном давлении. Процесс
можно выразить уравнением
nСО+(2n+1)Н 2 ® 200° C n H 2n+2 +nН 2 O
I Итак, основным источником алканов служат природный газ и нефть. Однако некоторые предельные углеводороды синтезируют из других соединений.
Применение алканов
Большая часть алканов используется как топливо. Крекинг и
Дегидрирование их приводит к непредельным углеводородам, на
базе которых получают множество других органических веществ.
Метан - основная часть природных газов (60-99%). В состав
природных газов входят пропан и бутан. Жидкие углеводороды
применяются в качестве горючего в двигателях внутреннего сгорания а автомашинах, самолетах и др. Очищенная смесь жидких
и твердых алканов образует вазелин. Высшие алканы являются
исходными веществами при получении синтетических моющих средств. Алканы, полученные путем изомеризации, используются в производстве высококачественных бензинов и каучука. Ниже приведена схема применения метана

Циклоалканы
Строение
Циклоалканы - насыщенные углеводороды, в молекулах которых имеется замкнутое кольцо из углеродных атомов.
Циклоалканы (циклопарафины) образуют гомологический ряд с общей формулой С n Н 2 n , в котором первым членом является
циклопропан С 3 Н 6 , т.к. для образования кольца необходимо наличие не менее трех атомов углерода.
Циклоалканы имеют несколько названий: циклопарафины, нафтены, цикланы, полиметилены. Примеры некоторых соединений:

Формула С n Н 2 n характерна для циклопарафинов, и точно такая же формула описывает гомологический ряд алкенов (непредельных углеводородов, имеющих одну кратную связь). Из этого можно сделать вывод, что каждому циклоалкану изомерен соответствующий алкен - это пример «межклассовой» изомерии.
Циклоалканы по размеру цикла делятся на ряд групп, из которых рассмотрим две: малые (С 3 , С 4) и обычные (С 5 -С 7) циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле проводят так, чтобы заместители получили наименьшие номера.
Структурные формулы циклоалканов обычно записываются в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода. Например:

Структурная изомерия циклоалканов обусловлена размером цикла (циклобутан и метилциклопропан - изомеры) и положением заместителей в цикле (например, 1,1- и 1,2-диметилбутан), а также их строением.
Пространственная изомерия также характерна для циклоалканов, т.к. она связана с различным расположением заместителей относительно плоскости цикла. При расположении заместителей по одну сторону от плоскости цикла получаются цис-изомеры, по разные стороны - транс-изомеры.
Предельные углеводороды - это такие соединения, которые представляют собой молекулы, состоящие из атомов углерода, находящихся в состоянии гибридизации sp 3 . Они связаны между собой исключительно ковалентными сигма-связями. Название «предельные» или «насыщенные» углеводороды исходит из того факта, что эти соединения не имеют возможности присоединять какие-либо атомы. Они предельны, полностью насыщены. Исключение составляют циклоалканы.
Что такое алканы?
Алканы - это углеводороды предельные, а их углеродная цепь незамкнута и состоит из атомов углерода, связанных между собой при помощи одинарных связей. Она не содержит иных (то есть двойных, как у алкенов, или же тройных, как у алкилов) связей. Алканы также называют парафинами. Это название они получили, так как общеизвестные парафины являются смесью преимущественно данных предельных углеводородов С 18 -С 35 с особой инертностью.
Общие сведения об алканах и их радикалах
Их формула: С n Р 2 n +2 , здесь n больше или равно 1. Молярная масса вычисляется по формуле: М = 14n + 2. Характерная особенность: окончания в их названиях - «-ан». Остатки их молекул, которые образуются в результате замещения водородных атомов на иные атомы, имеют название алифатических радикалов, или алкилов. Их обозначают буквой R. Общая формула одновалентных алифатических радикалов: С n Р 2 n +1 , здесь n больше или равно 1. Молярная масса алифатических радикалов вычисляется по формуле: М = 14n + 1. Характерная особенность алифатических радикалов: окончания в названиях «-ил». Молекулы алканов имеют свои особенности строения:
- связь С-С характеризуется длиной 0,154 нм;
- связь С-Н характеризуется длиной 0,109 нм;
- валентный угол (угол между связями углерод-углерод) равен 109 градусов и 28 минут.

Начинают гомологический ряд алканы: метан, этан, пропан, бутан и так далее.
Физические свойства алканов
Алканы - это вещества, которые не имеют цвета и нерастворимы в воде. Температура, при которой алканы начинают плавиться, и температура, при которой они закипают, повышаются в соответствии с увеличением молекулярной массы и длины углеводородной цепи. От менее разветвленных к более разветвленным алканам температуры кипения и плавления понижаются. Газообразные алканы способны гореть бледно-голубым либо бесцветным пламенем, при этом выделяется довольно много тепла. СН 4 -С 4 Н 10 представляют собой газы, у которых отсутствует также и запах. С 5 Н 12 -С 15 Н 32 - это жидкости, которые обладают специфическим запахом. С 15 Н 32 и так далее - это твердые вещества, которые также не имеют запаха.
Химические свойства алканов
Данные соединения являются малоактивными в химическом плане, что можно объяснить прочностью трудноразрываемых сигма-связей - С-С и С-Н. Также стоит учитывать, что связи С-С неполярны, а С-Н малополярны. Это малополяризуемые виды связей, относящиеся к сигма-виду и, соответственно, разрываться по наибольшей вероятности они станут по механизму гомолитическому, в результате чего будут образовываться радикалы. Таким образом, химические свойства алканов в основном ограничиваются реакциями радикального замещения.

Реакции нитрования
Алканы взаимодействуют только с азотной кислотой с концентрацией 10% либо с оксидом четырехвалентного азота в газовой среде при температуре 140°С. Реакция нитрования алканов носит название реакции Коновалова. В результате образуются нитросоединения и вода: CH 4 + азотная кислота (разбавленная) = CH 3 - NO 2 (нитрометан) + вода.
Реакции горения
Предельные углеводороды очень часто применяются как топливо, что обосновано их способностью к горению: С n Р 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n СО 2 .
Реакции окисления
В химические свойства алканов также входит их способность к окислению. В зависимости от того, какие условия сопровождают реакцию и как их изменяют, можно из одного и того же вещества получить различные конечные продукты. Мягкое окисление метана кислородом при наличии катализатора, ускоряющего реакцию, и температуры около 200 °С может дать в результате следующие вещества:
1) 2СН 4 (окисление кислородом) = 2СН 3 ОН (спирт - метанол).
2) СН 4 (окисление кислородом) = СН 2 О (альдегид - метаналь или формальдегид) + Н 2 О.
3) 2СН 4 (окисление кислородом) = 2НСООН (карбоновая кислота - метановая или муравьиная) + 2Н 2 О.

Также окисление алканов может производиться в газообразной или жидкой среде воздухом. Такие реакции приводят к образованию высших жирных спиртов и соответствующих кислот.
Отношение к нагреванию
При температурах, не превышающих +150-250°С, обязательно в присутствии катализатора, происходит структурная перестройка органических веществ, которая заключается в изменении порядка соединения атомов. Данный процесс называется изомеризацией, а вещества, полученные в результате реакции - изомерами. Таким образом, из нормального бутана получается его изомер - изобутан. При температурах 300-600°С и наличии катализатора происходит разрыв связей С-Н с образованием молекул водорода (реакции дегидрирования), молекул водорода с замыканием углеродной цепи в цикл (реакции циклизации или ароматизации алканов):
1) 2СН 4 = С 2 Н 4 (этен) + 2Н 2.
2) 2СН 4 = С 2 Н 2 (этин) + 3Н 2.
3) С 7 Н 16 (нормальный гептан) = С 6 Н 5 - СН 3 (толуол) + 4Н 2 .

Реакции галогенирования
Такие реакции заключаются во введении в молекулу органического вещества галогенов (их атомов), в результате чего образуется связь С-галоген. При взаимодействии алканов с галогенами образуются галогенпроизводные. Данная реакция обладает специфическими особенностями. Она протекает по механизму радикальному, и чтобы ее проинициировать, необходимо на смесь галогенов и алканов воздействовать ультрафиолетовым излучением или же просто нагреть ее. Свойства алканов позволяют реакции галогенирования протекать, пока не будет достигнуто полное замещение на атомы галогена. То есть хлорирование метана не закончится одной стадией и получением метилхлорида. Реакция пойдет далее, будут образовываться все возможные продукты замещения, начиная с хлорметана и заканчивая тетрахлорметаном. Воздействие хлора при данных условиях на другие алканы приведет к образованию различных продуктов, полученных в результате замещения водорода у различных атомов углерода. От температуры, при которой идет реакция, будет зависеть соотношение конечных продуктов и скорость их образования. Чем длиннее углеводородная цепь алкана, тем легче будет идти данная реакция. При галогенировании сначала будет замещаться атом углерода наименее гидрированый (третичный). Первичный вступит в реакцию после всех остальных. Реакция галогенирования будет происходить поэтапно. На первом этапе заместиться только один атом водорода. C растворами галогенов (хлорной и бромной водой) алканы не взаимодействуют.

Реакции сульфохлорирования
Химические свойства алканов также дополняются реакцией сульфохлорирования (она носит название реакции Рида). При воздействии ультрафиолетового излучения алканы способны реагировать со смесью хлора и диоксида серы. В результате образуется хлороводород, а также алкильный радикал, который присоединяет к себе диоксид серы. В результате получается сложное соединение, которое становится стабильным благодаря захвату атома хлора и разрушения очередной его молекулы: R-H + SO 2 + Cl 2 + ультрафиолетовое излучение = R-SO 2 Cl + HCl. Образовавшиеся в результате реакции сульфонилхлориды находят широкое применение в производстве поверхностно-активных веществ.








