Знаете ли вы, какова температура варящегося супа? 100 ˚С. Ни больше, ни меньше. При той же температуре закипает чайник, и варятся макароны. Что это значит?
Почему при постоянном подогреве кастрюльки или чайника горящим газом температура воды внутри не подымается выше ста градусов? Дело в том, что когда вода достигает температуры в сто градусов, вся поступающая тепловая энергия расходуется на переход воды в газообразное состояние, то есть испарение. До ста градусов испарение происходит в основном с поверхности, а достигнув этой температуры, вода закипает. Кипение - это тоже испарение, но только по всему объему жидкости. Пузырьки с горячим паром образуются внутри воды и, будучи легче воды, эти пузырьки вырываются на поверхность, а пар из них улетучивается в воздух.
До ста градусов температура воды при нагревании растет. После ста градусов при дальнейшем нагревании будет расти температура водяного пара. А вот пока вся вода не выкипит при ста градусах, ее температура не повысится, сколько энергии не прикладывай. Куда девается эта энергия, мы уже разобрались - на переход воды в газообразное состояние. Но раз существует такое явление, значит должна быть описывающая это явление физическая величина. И такая величина существует. Называется она удельной теплотой парообразования.
Удельная теплота парообразования воды
Удельная теплота парообразования - это физическая величина, которая показывает количество теплоты , нужное, чтобы превратить жидкость массой 1 кг в пар при температуре кипения. Обозначается удельная теплота парообразования буквой L. А единицей измерения является джоуль на килограмм (1 Дж/кг).
Удельную теплоту парообразования можно найти из формулы:
где Q - это количество теплоты,
m - масса тела.
Кстати, формула такая же, как и для расчета удельной теплоты плавления , разница лишь в обозначении. λ и L
Опытным путем найдены значения удельной теплоты парообразования различных веществ и составлены таблицы, откуда можно найти данные для каждого вещества. Так, удельная теплота парообразования воды равна 2,3*106 Дж/кг. Это означает, что на каждый килограмм воды необходимо потратить количество энергии, равное 2,3*106 Дж, чтобы превратить ее в пар. Но при этом вода должна уже обладать температурой кипения. Если вода изначально была более низкой температуры, то необходимо рассчитать еще то количество теплоты, которое потребуется для подогрева воды до ста градусов.
В реальных условиях часто требуется определить количество теплоты, необходимое для превращения в пар определенной массы какой-либо жидкости, поэтому чаще приходится иметь дело с формулой вида: Q=Lm, а значения удельной теплоты парообразования для конкретного вещества берут из готовых таблиц.
Для того чтобы поддерживать кипение воды (или иной жидкости), к ней нужно непрерывно подводить теплоту, например подогревать ее горелкой. При этом температура воды и сосуда не повышается, но за каждую единицу времени образуется определенное количество пара. Из этого следует вывод, что для превращения воды в пар требуется приток теплоты, подобно тому как это имеет место при превращении кристалла (льда) в жидкость (§ 269). Количество теплоты, необходимое для превращения единицы массы жидкости в пар той же температуры, называют удельной теплотой парообразования данной жидкости. Она выражается в джоулях на килограмм .
Нетрудно сообразить, что при конденсации пара в жидкость должно выделяться такое же количество теплоты. Действительно, опустим в стакан с водой трубку, соединенную с кипятильником (рис. 488). Через некоторое время после начала нагревания из конца трубки, опущенной в воду, начнут выходить пузыри воздуха. Этот воздух мало повышает температуру воды. Затем вода в кипятильнике закипит, после чего мы увидим, что пузыри, выходящие из конца трубки, уже не поднимаются вверх, а быстро уменьшаются и с резким звуком исчезают. Это - пузыри пара, конденсирующиеся в воду. Как только вместо воздуха из кипятильника пойдет пар, вода начнет быстро нагреваться. Так как удельная теплоемкость пара примерно такая же, как и воздуха, то из этого наблюдения следует, что столь быстрое нагревание воды происходит именно вследствие конденсации пара.

Рис. 488. Пока из кипятильника идет воздух, термометр показывает почти одну и ту же температуру. Когда вместо воздуха пойдет пар и начнет конденсироваться в стаканчике, столбик термометра быстро поднимется, показывая повышение температуры
При конденсации единицы массы пара в жидкость той же температуры выделяется количество теплоты, равное удельной теплоте парообразования. Это можно было предвидеть на основании закона сохранения энергии. Действительно, если бы это было не так, то можно было бы построить машину, в которой жидкость сначала испарялась, а затем конденсировалась: разность между теплотой парообразования и теплотой конденсации представляла бы приращение полной энергии всех тел, участвующих в рассматриваемом процессе. А это противоречит закону сохранения энергии.
Удельную теплоту парообразования можно определить с помощью калориметра, подобно тому, как это делается при определении удельной теплоты плавления (§ 269). Нальем в калориметр определенное количество воды и измерим ее температуру. Затем некоторое время будем вводить в воду пар испытуемой жидкости из кипятильника, приняв меры к тому, чтобы шел только пар, без капелек жидкости. Для этого пар пропускают сквозь сухопарник (рис. 489). После этого вновь измерим температуру воды в калориметре. Взвесив калориметр, мы можем по увеличению его массы судить о количестве пара, сконденсировавшегося в жидкость.

Рис. 489. Сухопарник - приспособление для задержания капелек воды, движущихся вместе с паром
Пользуясь законом сохранения энергии, можно составить для этого процесса уравнение теплового баланса, позволяющее определить удельную теплоту парообразования воды. Пусть масса воды в калориметре (включая водяной эквивалент калориметра) равна масса пара - , теплоемкость воды - , начальная и конечная температура воды в калориметре - и , температура кипения воды - и удельная теплота парообразования - . Уравнение теплового баланса имеет вид
![]() .
.
Результаты определения удельной теплоты парообразования некоторых жидкостей при нормальном давлении приведены в табл. 20. Как видно, эта теплота довольно велика. Большая теплота парообразования воды играет исключительно важную роль в природе, так как процессы парообразования совершаются в природе в грандиозных масштабах.
Таблица 20. Удельная теплота парообразования некоторых жидкостей
|
Вещество |
Вещество |
||
|
Спирт (этиловый) |
|||
Отметим, что содержащиеся в таблице значения удельной теплоты парообразования относятся к температуре кипения при нормальном давлении. Если жидкость кипит или просто испаряется при иной температуре, то ее удельная теплота парообразования иная. При повышении температуры жидкости теплота парообразования всегда уменьшается. Объяснение этого мы рассмотрим позже.
295.1. Определите количество теплоты, необходимое для нагревания до температуры кипения и для превращения в пар 20 г воды при .
295.2. Какая получится температура, если в стакан, содержащий 200 г воды при , впустить 3 г пара при ? Теплоемкостью стакана пренебречь.
На этом уроке мы уделим внимание такому виду парообразования, как кипение, обсудим его отличия от рассмотренного ранее процесса испарения, введем такую величину, как температура кипения, и обсудим, от чего она зависит. В конце урока введем очень важную величину, описывающую процесс парообразования - удельную теплоту парообразования и конденсации.
Тема: Агрегатные состояния вещества
Урок: Кипение. Удельная теплота парообразования и конденсации
На прошлом уроке мы уже рассмотрели один из видов парообразования - испарение - и выделили свойства этого процесса. Сегодня мы обсудим такой вид парообразования, как процесс кипения, и введем величину, которая численно характеризует процесс парообразования - удельная теплота парообразования и конденсации.
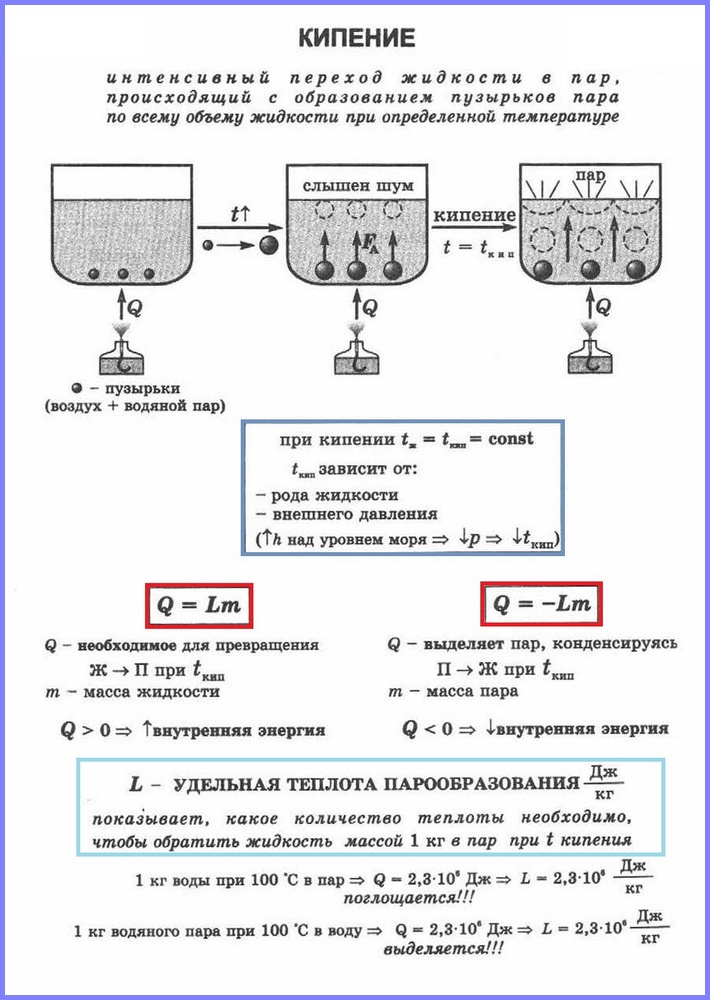
Определение. Кипение (рис. 1) - это процесс интенсивного перехода жидкости в газообразное состояние, сопровождающийся образованием пузырьков пара и происходящий по всему объему жидкости при определенной температуре, которую называют температурой кипения.
Сравним два вида парообразования между собой. Процесс кипения более интенсивен, чем процесс испарения. Кроме того, как мы помним, процесс испарения протекает при любой температуре выше температуры плавления, а процесс кипения - строго при определенной температуре, которая является различной для каждого из веществ и называется температурой кипения. Еще следует отметить, что испарение происходит только со свободной поверхности жидкости, т. е. с области, разграничивающей ее с окружающими газами, а кипение - сразу со всего объема.
Более подробно рассмотрим протекание процесса кипения. Представим ситуацию, с которой многие из нас неоднократно сталкивались, - это нагревание и кипячение воды в некотором сосуде, например, в кастрюле. В ходе нагревания воде будет передаваться определенное количество теплоты, что будет приводить к увеличению ее внутренней энергии и увеличению активности движения молекул. Этот процесс будет протекать до определенного этапа, пока энергия движения молекул не станет достаточной для начала кипения.
В воде присутствуют растворенные газы (или другие примеси), которые выделяются в ее структуре, что приводит к так называемому возникновению центров парообразования. Т. е. именно в этих центрах начинает происходить выделение пара, и по всему объему воды образовываются пузырьки, которые наблюдаются при кипении. Важно понимать, что в этих пузырьках находится не воздух, а именно пар, который образовывается в процессе кипения. После образования пузырьков количество пара в них растет, и они начинают увеличиваться в размерах. Зачастую, изначально пузырьки образуются вблизи стенок сосуда и не сразу поднимаются на поверхность; сначала они, увеличиваясь в размерах, оказываются под воздействием нарастающей силы Архимеда, а затем отрываются от стенки и поднимаются на поверхность, где лопаются и высвобождают порцию пара.
Стоит отметить, что далеко не сразу все пузырьки пара достигают свободной поверхности воды. В начале процесса кипения вода прогрета еще далеко не равномерно и нижние слои, вблизи которых происходит непосредственно процесс теплопередачи, еще горячее верхних, даже с учетом процесса конвекции. Это приводит к тому, что поднимающиеся снизу пузырьки пара схлопываются из-за явления поверхностного натяжения, еще не доходя до свободной поверхности воды. При этом пар, который находился внутри пузырьков, переходит в воду, тем самым дополнительно нагревая ее и ускоряя процесс равномерного прогрева воды по всему объему. В результате, когда вода прогревается практически равномерно, почти все пузырьки пара начинают достигать поверхности воды и начинается процесс интенсивного парообразования.
Важно выделить тот факт, что температура, при которой проходит процесс кипения, остается неизменной даже в том случае, если увеличивать интенсивность подвода тепла к жидкости. Простыми словами, если в процессе кипения прибавить газ на конфорке, которая разогревает кастрюлю с водой, то это приведет только к увеличению интенсивности кипения, а не к увеличению температуры жидкости. Если углубляться более серьезно в процесс кипения, то стоит отметить, что в воде возникают области, в которых она может быть перегрета выше температуры кипения, но величина такого перегрева, как правило, не превышает одного-пары градусов и незначительна в общем объеме жидкости. Температура кипения воды при нормальном давлении составляет 100°С.
В процессе кипения воды можно заметить, что он сопровождается характерными звуками так называемого бурления. Эти звуки возникают как раз из-за описанного процесса схлопывания пузырьков пара.
Процессы кипения других жидкостей протекают аналогичным образом, что и кипение воды. Основное отличие в этих процессах составляют различные температуры кипения веществ, которые при нормальном атмосферном давлении являются уже измеренными табличными величинами. Укажем основные значения этих температур в таблице.
Интересен тот факт, что температура кипения жидкостей зависит от величины атмосферного давления, поэтому мы и указывали, что все значения в таблице приведены при нормальном атмосферном давлении. При возрастании давления воздуха возрастает и температура кипения жидкости, при уменьшении, наоборот, уменьшается.
На этой зависимости температуры кипения от давления окружающей среды основан принцип работы такого известного кухонного прибора, как скороварка (рис. 2). Она представляет собой кастрюлю с плотно закрывающейся крышкой, под которой в процессе парообразования воды давление воздуха с паром достигает значения до 2 атмосферных давлений, что приводит к увеличению температуры кипения воды в ней до . Из-за этого вода с продуктами в ней имеют возможность нагреться до температуры выше, чем обычно (), и процесс приготовления ускоряется. Из-за такого эффекта устройство и получило свое название.

Рис. 2. Скороварка ()
Ситуация с уменьшением температуры кипения жидкости с понижением атмосферного давления также имеет пример из жизни, но уже не повседневной для многих людей. Относится такой пример к путешествиям альпинистов в высокогорных районах. Оказывается, что в местности, находящейся на высоте 3000-5000 м, температура кипения воды из-за уменьшения атмосферного давления снижается до и более низких значений, что приводит к сложностям при приготовлении пищи в походах, т. к. для эффективной термической обработки продуктов в таком случае требуется значительно большее время, чем при нормальных условиях. На высотах около 7000 м температура кипения воды доходит до , что приводит к невозможности приготовления многих продуктов в таких условиях.
На том, что температуры кипения различных веществ отличаются, основаны некоторые технологии разделения веществ. Например, если рассматривать нагревание нефти, которая представляет собой сложную жидкость, состоящую из множества компонентов, то в процессе кипения ее можно будет разделить на несколько различных веществ. В данном случае, благодаря тому, что температуры кипения керосина, бензина, лигроина и мазута различны, их можно отделить друг от друга путем парообразования и конденсации при различных температурах. Такой процесс, как правило, называют разделением на фракции (рис. 3).

Рис. 3 Разделение нефти на фракции ()
Как и любой физический процесс, кипение необходимо характеризовать с помощью какой-то численной величины, такую величину называют удельной теплотой парообразования.
Для того чтобы понять физический смысл этой величины, рассмотрим следующий пример: возьмем 1 кг воды и доведем ее до температуры кипения, затем замерим, какое количество теплоты необходимо для того, чтобы полностью испарить эту воду (без учета тепловых потерь) - эта величина и будет равна удельной теплоте парообразования воды. Для другого вещества это значение теплоты будет другим и будет являться удельной теплотой парообразования этого вещества.
Удельная теплота парообразования оказывается очень важной характеристикой в современных технологиях производства металлов. Оказывается, что, например, при плавлении и испарении железа с его последующей конденсацией и затвердеванием образуется кристаллическая решетка с такой структурой, которая обеспечивает более высокую прочность, чем исходный образец.
Обозначение : удельная теплота парообразования и конденсации (иногда обозначается ).
Единица измерения : .
Удельная теплота парообразования веществ определяется с помощью экспериментов в лабораторных условиях, и ее значения для основных веществ занесены в соответствующую таблицу.
|
Вещество |
Удельная теплоемкость
Удельная теплоемкость - это количество тепла в Джоулях (Дж), необходимое для повышения температуры вещества. Удельная теплоемкость является функцией температуры. Для газов необходимо проводить различие между удельной теплоемкостью при постоянном давлении и при постоянном объеме.
Удельная теплота плавления
Удельная теплота плавления твердого вещества - это количество тепла в Дж, необходимое для перевода 1 кг вещества из твердого состояния в жидкое при температуре плавления.
Скрытая теплота парообразования
Скрытая теплота парообразования жидкости - это количество тепла в Дж, необходимое для испарения 1 кг жидкости при температуре кипения. Скрытая теплота парообразования сильно зависит от давления. Пример: если к емкости, содержащей 1 кг воды при 100С (на уровне моря) подвести тепло, вода поглотит 1023 кДж скрытого тепла без какого-либо изменения в показаниях термометра. Однако, произойдет изменение агрегатного состояния из жидкости в пар. Поглощенное водой тепло называется скрытой теплотой парообразования. Пар сохранит 1023 кДж, поскольку эта энергия требовалась для изменения агрегатного состояния.
Скрытая теплота конденсации
При обратном процессе, когда тепло отводится от 1 кг водяного пара при 100С (на уровне моря), пар выделит 1023 кДж тепла без изменения в показаниях термометра. Однако, произойдет изменение агрегатного состояния из пара в жидкость. Поглощенное водой тепло называется скрытой теплотой конденсации.
Температура и давление

Тепловые измерения
Температура, или ИНТЕНСИВНОСТЬ тепла, измеряется термометром. Большинство значений температуры в данном руководстве приводятся в градусах Цельсия (С), однако иногда используются и градусы Фаренгейта (F). Значение температуры говорит только об интенсивности тепла или о ЯВНОМ ТЕПЛЕ, а не о действительном количестве тепла. Комфортная температура для человека находится в пределах от 21 до 27С. В этом диапазоне температур человек чувствует себя наиболее комфортно. Когда любая температура выше или ниже этого диапазона, человек воспринимает это как теплое или холодное. В науке существуют понятие «абсолютный ноль» - температура, при которой от тела отведено все тепло. Температура абсолютного нуля определяется как –273°C. Любое вещество при температуре выше абсолютного нуля содержит некоторое количество тепла. Для понимания основ кондиционирования воздуха также необходимо понимать связь между давлением, температурой и агрегатным состоянием. Наша планета окружена воздухом, иначе говоря газом. Давление в газе передается во всех направлениях одинаково. Окружающий нас газ состоит на 21% из кислорода и на 78% из азота. Остающийся 1% занимают другие редкие газы. Эта комбинация газов называется атмосферой. Она простирается на несколько сотен километров над земной поверхностью и удерживается силой гравитации. На уровне моря атмосферное давление составляет 1,0 бар, а точка кипения воды - 100С. В любой точке выше уровня моря атмосферное давление ниже, а также ниже температура кипения воды. При понижении давления до 0,38 бар, температура кипения воды составляет 75С, а при давлении 0,12 бар - 50С. Если на точку кипения воды влияет уменьшение давления, логично предположить, что увеличение давления также на нее повлияет. Пример - пароварочный котел!
Дополнительная информация: как перевести градусы Фаренгейта в градусы Цельсия и наоборот: C = 5/9 × (F – 32). F = (9/5 × C)+32. Кельвин = C + 273. Ренкин = F + 460.
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием . Парообразование может осуществляться в виде двух процессов: и.
Кипение
Второй процесс парообразования - кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют . Температуру, при которой жидкость кипит, называют температурой кипения .
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L ) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования - [L ] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L ) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.